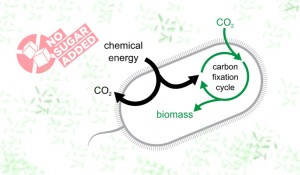
Les bactéries étudiées dans le laboratoire du professeur Ron Milo de l’Institut Weizmann des Sciences ont renoncé au sucre, elles ont cessé de consommer tous les aliments solides normaux, pour se concentrer sur le dioxyde de carbone (CO2) dans leur environnement. Autrement dit, elles sont en mesure de constituer toute leur biomasse à partir de l’air. Cet exploit implique près d’une décennie de conception rationnelle, de génie génétique et une version accélérée d’évolution en laboratoire. Les résultats soulignent les moyens de développer, à l’avenir, des carburants neutres en carbone.
De telles bactéries pourraient, à l’avenir, contribuer à de nouvelles technologies plus efficaces en termes de bilan carbone.
L’étude a commencé par identifier les gènes cruciaux dans le processus de fixation du carbone – la façon dont les plantes captent le carbone du CO2 dans le but de le transformer en molécules biologiques telles que les protéines, l’ADN, etc. L’équipe de recherche a ajouté et recâblé les gènes nécessaires. Ils ont découvert que bon nombre de « pièces » de cette machinerie étaient déjà présentes dans le génome bactérien et pouvaient être utilisées telles quelles. Ils ont également inséré un gène permettant aux bactéries d’obtenir de l’énergie à partir d’une substance largement disponible appelée formate, cette substance pouvant être produite directement à partir de l’électricité et de l’air est en mesure de « céder » des électrons aux bactéries.
Il s’est avéré que doter les bactéries avec des « moyens de production » ne suffisait pas pour effectuer un tel changement. Il fallait encore une autre astuce pour que les bactéries utilisent ces machines correctement, ce qui impliquait un délicat exercice d’équilibrage. Avec Roee Ben-Nissan, Yinon Bar-On et d’autres membres de l’équipe de Milo du Département des Sciences Végétales et Environnementales de l’Institut, Gleizer a utilisé l’évolution en laboratoire, dans la mesure où cette technique est connue ; en substance, les bactéries ont été progressivement sevrées du sucre qu’elles avaient l’habitude de consommer. À chaque étape, les bactéries cultivées ont reçu juste suffisamment de sucre pour les empêcher de mourir de faim, ainsi qu’une grande quantité de CO2 et de formate. Pendant que certaines « apprenaient » à développer un goût pour le CO2 (en leur donnant un avantage évolutif par rapport à celles restreintes au sucre), leurs descendants ont reçu de moins en moins de sucre jusqu’à ce qu’après environ un an d’adaptation au nouveau régime, certaines d’entre elles ont finalement opéré un basculement complet, en vivant et en se multipliant dans un environnement offrant un CO2 pur.
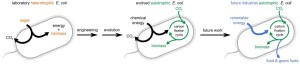
Researchers converted the common lab, sugar-eating (heterotrophic) E. coli bacterium (left) to producing all of its biomass from CO2 (autotrophic), using metabolic engineering combined with lab evolution. The new bacterium (center) uses the compound formate as a form of chemical energy to drive CO2 fixation by a synthetic metabolic pathway. The bacterium may provide the infrastructure for the future renewable production of food and green fuels (right)
Pour vérifier si les bactéries ne « grignotaient » pas d’autres nutriments, certains des E. coli développés ont été nourris avec du CO2 contenant un isotope lourd – C13. Ensuite, les parties bactériennes du corps ont été pesées et le poids gagné a été comparé à la masse qui se serait ajoutée par une alimentation basée sur une version plus lourde de carbone. L’analyse a montré que les atomes de carbone dans le corps des bactéries étaient tous extraits directement du CO2 uniquement.
L’équipe de recherche a ensuite entrepris de caractériser les bactéries nouvellement développées. Quels changements ont été essentiels pour s’adapter à ce nouveau régime ? Alors que certaines modifications génétiques identifiées ont pu être liées à la survie à la faim, d’autres ont semblé réguler la synchronisation des étapes de la fabrication de blocs de construction par accumulation de CO2. « La cellule doit trouver un équilibre entre la congestion toxique et la faillite », explique Bar-On. Pourtant, d’autres changements notés par l’équipe concernaient la transcription – la régulation de l’activation et de la désactivation des gènes existants. « Des recherches plus approfondies permettront, espérons-le, de savoir exactement comment ces gènes ont ajusté leurs activités », explique Ben-Nissan.
Les chercheurs sont d’avis que le nouveau « coup de pouce » de la bactérie pourrait finalement être sain pour la planète. Milo souligne qu’aujourd’hui, les sociétés de biotechnologie utilisent des cultures cellulaires pour produire des produits chimiques de base. Ces cellules – levures ou bactéries – pourraient être amenées à vivre avec un régime de CO2 et d’électricité renouvelable, et ainsi être sevrées des grandes quantités de sirop de maïs sur lesquelles elles vivent aujourd’hui. Les bactéries pourraient s’adapter davantage de sorte que plutôt que de prendre leur énergie d’une substance telle que le formate, elles pourraient être en mesure de l’obtenir directement – par les électrons d’un capteur solaire – et de stocker cette énergie par la suite pour une utilisation ultérieure comme combustible sous la forme de carbone fixé dans leurs cellules. Un tel carburant serait neutre en carbone si la source de son carbone était le CO2 atmosphérique.
« Notre laboratoire a été le premier à poursuivre l’idée de modifier le régime alimentaire d’un hétérotrophe normal (qui mange des substances organiques) pour le convertir en autotrophie (« vivre dans l’air ») », explique Ron Milo. « Cela paraissait impossible au départ, mais nous avons tiré de nombreuses leçons en cours de route, et à la fin, nous avons montré que cela pouvait s’avérer effectivement possible. Nos résultats sont une étape importante vers notre objectif d’applications scientifiques efficaces et écologiques. »
Publication dans Cell,